Dans tous vos dispositifs de vape, il y a un accumulateur alimentant votre atomiseur en courant électrique. Improprement appelé batterie, l’accumulateur est une cellule produisant du courant électrique par réaction électrochimique à base d’ions de lithium, d’où le nom d’accu Li-ion. Alors, un accu, comment ça fonctionne ?
Le courant électrique (mais vite fait alors)
Le courant électrique, c’est une circulation d’électrons libres en ordre de marche. Ce postulat étant établi, ça veut dire quoi ? Dans la nature, toute la matière est composée d’atomes. Un atome est composé d’un noyau composé de particules appelées protons et neutrons (sauf l’hydrogène à l’état natif) avec des électrons qui gravitent autour de ce noyau. Les éléments d’un atome possèdent une charge électrique, sauf le neutron (d’où son nom). Le proton a une charge électrique positive et l’électron, négative ; et ça, c’est important.
Les électrons sont nos amis
Ce qui nous intéresse, ce sont les électrons. En principe, il y a autant d’électrons que de protons dans un atome. Ces électrons sont organisés en couches successives, chacune ayant un nombre d’électrons maximum. La première, la couche K ne peut avoir que deux électrons. La deuxième, la couche (L) ne peut en contenir que 8. La troisième (M) 18, et ainsi de suite.
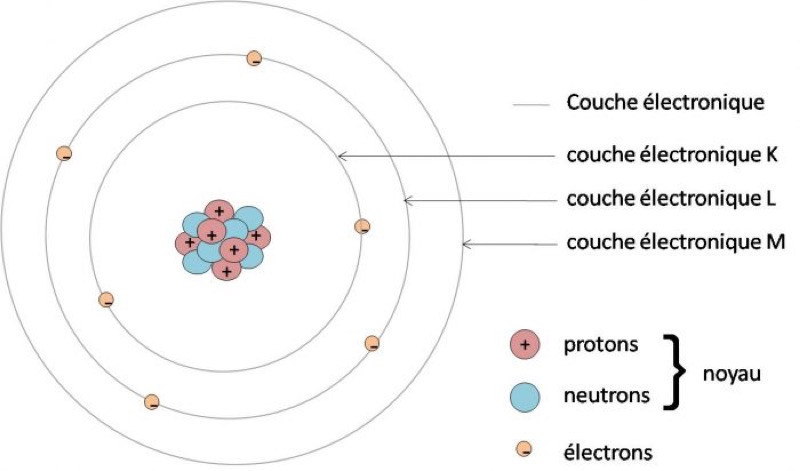
La couche extérieure d’un atome est appelée couche de valence. Si cette couche est complète (ex : 18 électrons pour la 3e couche), l’atome est chimiquement stable. Si elle est incomplète, l’atome est instable car il peut encore accueillir des électrons.
Tous les métaux sont des éléments chimiquement instables. Les électrons de la couche de valence d’un métal sont constamment agités, de façon complètement désordonnée.
Quand on soumet champ électrique à un matériau instable, les électrons de la couche de valence vont se mettre à circuler en ordre de marche, d’un atome à l’autre, comme de bons petits soldats. Quand le courant s’arrête, l’élément conducteur retrouve son état fondamental désordonné.
Un petit test ?
Comment fabriquer un courant électrique ? Simple. Prenez un fil de cuivre un (peu long quand même) et placez un voltmètre aux deux extrémités de ce fil. Ensuite, prenez un aimant et passez-le tout le long du fil et vous verrez le voltmètre capter une tension électrique ; faible, mais bien réelle. Cette relation indéfectible entre électricité et magnétisme a été formalisée par James Clerk Maxwell en 1864 avec 4 lois qui sont le fondement de l’électromagnétisme.
Résumé
Le courant électrique, c’est un flux d’électrons circulant tous dans le même sens. On a vu ci-dessus comment créer un courant électrique avec un champs magnétique. C’est le même principe qui génère le courant de vos prises à la maison, avec des alternateurs géants dans une centrale. Mais il y a d’autres procédés pour générer du courant. La chimie par exemple.
Le Lithium

Le Lithium est un métal alcalin très léger et le premier métal du tableau périodique des éléments. Son numéro atomique est 3 et le symbole, vous l’avez deviné : Li. Le Lithium a un noyau comportant 3 protons. Il possède donc 3 électrons en orbite. La première couche électronique comporte 2 électrons. Elle est donc complète. La deuxième couche en possède un seul. Ah ! Le Lithium est donc instable et c’est pourquoi il peut servir à un certain nombres de réactions chimiques. En revanche, tel quel, il est électriquement neutre.
L’Ion
Un atome peut très bien perdre un électron sans qu’il soit changé en autre chose. Lorsqu’un électron quitte son nid, l’atome est maintenant composé d’un noyau avec X protons moins un électron. La charge électrique est donc maintenant positive puisqu’il y a plus de protons que d’électrons (vous vous souvenez … les charges électriques des particules ?). Voilà, nous y sommes. Un atome avec une charge électrique s’appelle un Ion.
L’atome perd un électron, c’est un Ion positif ou Ion+
Lithium-Ion, ça veut dire quoi ?
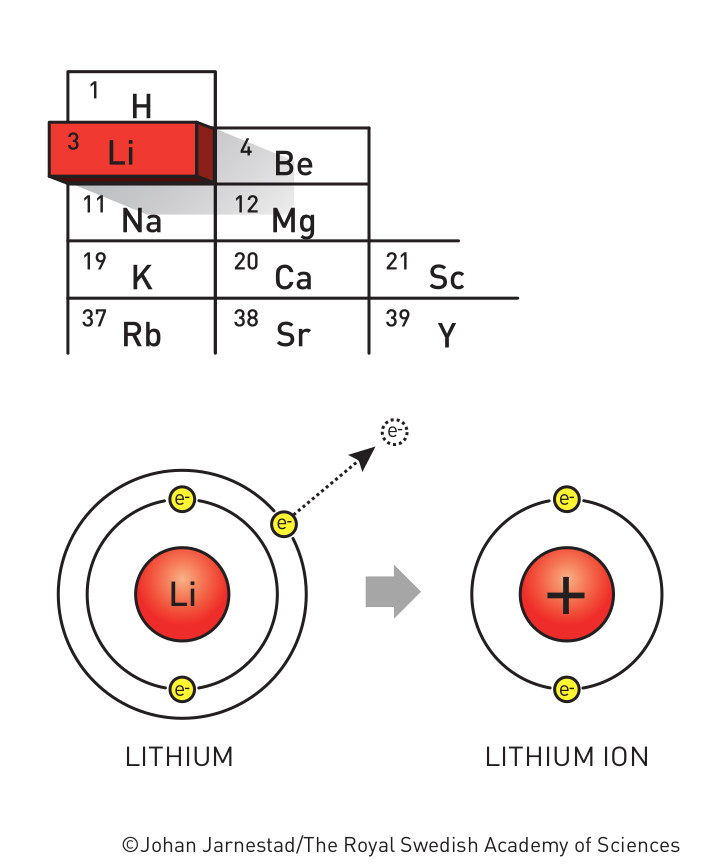
Nous l’avons vu, le Lithium à un noyau composé de trois protons autour duquel gravitent trois électrons. L’atome a alors une charge électrique neutre (trois +, trois -, c’est neutre). Mais si on soumet une charge électrique positive à l’atome de Lithium, l’électron de la couche extérieure va quitter son orbite en étant attiré par cette charge. Selon ce qu’on a dit au-dessus, l’atome de Lithium est devenu un Ion positif noté Li+.
En fait, c’est quoi un accu ?
Un accu, c’est une enceinte composée de deux électrodes appelée anode (pôle négatif) et cathode (pôle positif). C’est entre ces deux électrodes que va circuler le courant électrique. Pour que la réaction chimique se fasse, une batterie a besoin d’un matériau « reliant », en interne, les deux électrodes. Cela s’appelle un électrolyte et cet élément va servir à faire circuler les ions lithium d’une électrode à l’autre tout en interdisant aux électrons de passer par là pour aller rejoindre l’électrode positive.
Le principe chimique régissant un accumulateur s’appelle l’oxydoréduction (ou ReDox). Dans ce principe, un réactif qui cède un ou plusieurs électrons est un oxydant. Celui qui en capture est un réducteur. C’est cette réaction chimique qui va permettre le flux d’électrons entre l’anode et la cathode (décharge), puis, inversement, entre la cathode et l’anode (charge)
Concernant nos accus, l’anode est composée de graphite (le truc qu’il y a dans vos mines de crayons de papier). Pour la cathode, plusieurs structures peuvent être mises en jeu. Celle qui nous concerne s’appelle INR et est composée de Lithium-Manganèse-Nickel-Cobalt-Oxygène (LiNiMnCoO2). Ces deux structures vont servir de zones de stockage aux ions Lithium.
Alors, comment ça marche ?
Principe
Prenons un accu chargé. L’anode en graphite a stocké tout le Lithium qui, alors, est sous sa forme électrique neutre (3 protons-3 électrons, vous vous souvenez ?). En fait, le graphite a une structure cristalline en couches, ce qui permet d’intercaler des atomes de Lithium. Du côté cathode, l’assemblage LiNiMnCoO2 est aussi sous forme cristalline ; il a une charge globale positive qui attire les électrons et une structure pouvant stocker des Ions-Lithium. On ne rentrera pas dans les détails du comment.
Résumons : côté anode, on a des atomes de Lithium avec des électrons qui aimeraient bien se balader, et côté cathode, on a une structure de charge positive et un stockage à Ion Lithium. Vous voyez venir le truc ?
J’appuie sur le switch Fire, je décharge l’accu
Voilà, tout est prêt et vous appuyez sur votre Fire. A ce moment, vous créez une autoroute à électrons en reliant l’anode et la cathode1. Les électrons baladeurs côté anode se précipitent pour rejoindre la charge positive, à l’autre bout de l’accu en alimentant votre atomiseur au passage. A ce moment, les atomes de Lithium de l’anode se transforment en Ions et quittent leur structure de graphite. Au fur et à mesure que les électrons arrivent côté cathode, celle-ci devient de plus en plus négative. A contrario, côté anode, on a une charge de plus en plus positive et les Ions-Lithium s’accumulent ; mais en fait non. Puisque la structure de la cathode se « négativifie » elle est aussi candidate à accueillir des Ions positifs. Oui, oui, ceux qui s’accumulent dans l’anode. Ces Ions vont pouvoir aller rejoindre la cathode grâce à l’électrolyte placée entre les deux électrodes.
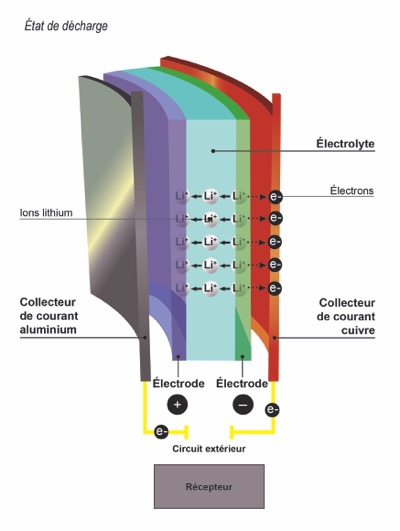
Nous y sommes. Les électrons circulent pour créer le courant électrique et les Ions Lithium migrent vers la cathode où ils seront stockés. Les électrons, eux, vont s’accrocher à la structure de la cathode puisque celle-ci est en déficit d’électrons et cherche à s’équilibrer électriquement.
1 : Les électrons circulent bien du – vers le + et non l’inverse. Il s’agit juste d’une plantade des scientifiques du début de la découverte du courant électrique. Ils pensaient que les porteurs de charge (appelé électrons depuis), étaient chargés positivement et non négativement. Cependant, les conventions sont restées et on parle toujours de sens du courant de la borne + vers la borne -.
Je branche le chargeur, je charge l’accu
Tous les Ions Lithium sont passés côté cathode via l’électrolyte, après avoir alimenté votre box/atomiseur. L’accu est donc déchargé.
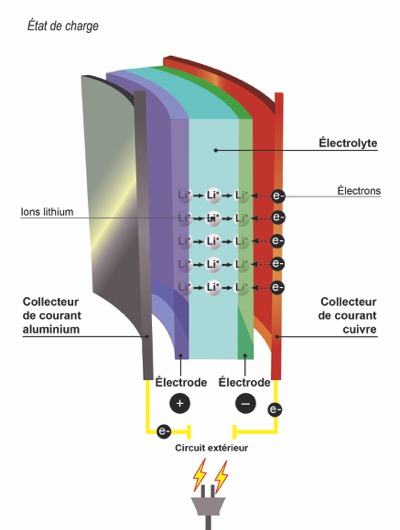
Maintenant, on va faire l’inverse en faisant circuler un courant continu externe (le chargeur) entre la cathode et l’anode. A ce moment, la réaction inverse s’opère : les électrons repartent vers l’anode. Celle-ci devient négative et va attirer les Ions-Lithium stockés côté cathode, toujours via l’électrolyte. Ces Ions vont donc récupérer leur électron baladeur une fois revenus au bercail et revenir à leur état initial d’atome de Lithium. Une fois tous les Ions-Lithium revenus à l’anode, la batterie est chargée.
Par construction, tous nos accus Lithium-Ion ont une tension de charge maximale de 4,2V et une tension nominale de 3,7V.
Fin de vie
Malheureusement, ce phénomène chimique n’est pas éternel. Au fur et à mesure des cycles de charge et décharge, il s’opère une réaction entre le Lithium et l’électrolyte. A mesure de l’utilisation de l’accu, il se forme un composé appelée SEI (Solid-Electrolyte Interphase). Ce composé absorbe irrémédiablement le Lithium et l’électrolyte. A un moment, l’accu ne peut plus faire circuler de courant et il est bon pour le recyclage.
Les précautions
Les accus Ion-Lithium nécessitent quelques précautions d’usage qu’il faut bien connaître.
La décharge profonde
Il y a un seuil en-dessous duquel il ne faut pas que l’accu descende. Ce seuil est de 3V. En dessous, la cathode accumule trop d’Ions-Lithium ce qui forme de l’oxyde de Lithium et de l’oxyde de Cobalt. Ces deux molécules sont stables et le processus est irréversible. Du coup, l’accu perd du Lithium et du Cobalt ; et donc, de la capacité. Ne vous inquiétez pas, vox box électroniques gèrent ça nativement. Faites le test avec une box à accus amovibles : quand la box vous dit que l’accu est vide, sortez-le et prenez un voltmètre. Vous constaterez que l’accu présente encore entre 3,2V et 3,4V à ses bornes.
Pour les proprios de box ou tubes mécaniques, faites attention à ce seuil de décharge. Mais globalement, la vape est trop faiblarde une fois l’accu arrivé à 3,5V.
Le court-circuit
Le truc à ne jamais faire. En faisant un court-circuit franc, la réaction chimique s’emballe provoquant une surchauffe de l’accu. L’électrolyte va se rompre … et c’est le drame ! Vous connaissez la suite : l’accu dégaze et se transforme en chalumeau. C’est pour ça que vous verrez des petits trous dans vos box : c’est pour permettre un dégazage de l’accu en évitant la surpression et l’éventuelle explosion de tout le système. Pour rappel, les fils de vos résistances peuvent descendre très bas (en dessous de 0,1Ω si on joue avec du reconstructible de cochon). Le court-circuit franc est géré par les box électroniques et empêche le fonctionnement.
De même, un grand coup de marteau sur un accu Li-Ion peut casser la barrière de l’électrolyte et provoquer la réaction en chaîne menant au dégazage/chalumeau.
Pour le méca … faites vraiment gaffe. Certains y ont laissé leur vie. Même si votre montage est correct et ne provoque pas de court-circuit franc, votre accu pourrait ne pas supporter votre coil et s’emballer également. Regardez ce que peut fournir votre batterie et utilisez la loi d’Ohm.
Calcul des capacités d’accus
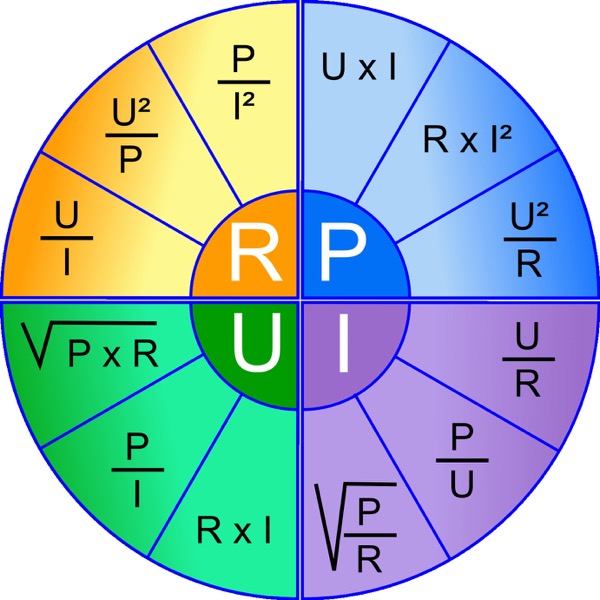
Les fabricants d’accus doivent indiquer deux chiffres : le courant de décharge maxi en continu et le courant de décharge en impulsions. Pour plus de sûreté, retenez seulement le courant de décharge en continu. Les formules de base de la loi d’Ohm sont les suivantes : U=R*I , I=U/R , P=U2/R. Avec :
- U : la tension en Volts
- R : la résistance en Ohms
- I : le courant en Ampères
- P : la puissance en Watts
Ex : je fais un coil d’une valeur de 0,5Ω et j’ai un accu LG-HG2 pouvant sortir 20A en continu. La pleine charge de l’accu est donc de 4,2V, comme cité plus haut. Bien … faisons le calcul. Je veux savoir ce que cette résistance va demander à l’accu en terme de courant (en Ampères pour rappel). Nous allons donc prendre la formule :
I = U/R, donc 4,2/0,5. Cela nous donne : 8,4A. Bieeeeeeen !
Maintenant, je fais un coil de 0,1Ω (si, si, il y en a qui font ça) :
I = U/R, donc 4,2/0,1 = 42A. Pas bieeeeeen !
Sans rire, ne faites pas les zouaves avec ça. C’est vraiment dangereux. Si vous êtes sur des mods mécaniques, surveillez toujours la résistance de l’atomiseur une fois monté et traquez les courts-circuits francs. De même, les accus tout nus dans la poche avec des pièces de monnaie et/ou des clés, vous oubliez. Quand vous transportez un accu, il doit toujours être protégé par une chaussette en silicone ou une boite en plastique.
La charge
Utilisez toujours un chargeur adapté pour vos accus. En effet, une tension de charge au-delà de 4,2V entrainerait une surchauffe de l’accu avec des conséquences qui pourraient vous coûter cher. Pour une charge directement en box, pas d’inquiétude, c’est géré aussi.
La protection
Les accus Lithium-Ion se présentent sous forme de tube, plus ou moins larges et longs. Le pôle positif, c’est la petite capsule avec le cerclage blanc. Le pôle négatif, c’est tout le reste. Pour éviter les court-circuits, la cellule est donc protégée par une feuille d’isolant en ne laissant apparaître que l’opposé au pôle positif. Si cette feuille est déchirée et que le tube est à nu, l’accu est d’autant plus susceptible d’entrer en court-circuit. Veillez à avoir une protection en bon état. Vous pouvez d’ailleurs reconstituer cette protection avec ce qu’on appelle un « wrap ». On en trouve de toutes les couleurs dans les bons shops.
Conclusion
Voilà. Vous savez tout ou presque. Mettre au point un accumulateur de courant est un domaine de recherche complexe et long. Vous allez vous dire : mais pourquoi le Lithium ? Et bien, parce que c’est justement un élément léger et suffisamment instable pour créer du courant. Le Graal d’un fabricant d’accus, c’est de trouver le meilleur compromis poids/volume/densité énergétique. Aujourd’hui, c’est le Lithium. Mais la recherche avance pour améliorer sans cesse les processus chimiques.
Alors, prenez soin de vos accus 😉
Sources :
Les réactions d’oxydo-réduction : définitions : https://www.unamur.be/sciences/enligne/transition/chimie/fichesderevision/revision8/definition.htm
https://www.nobelprize.org/uploads/2019/10/advanced-chemistryprize2019.pdf
BU-205: Types of Lithium-ion : https://batteryuniversity.com/learn/article/types_of_lithium_ion
Degradation of the solid electrolyte interphase induced by the deposition of manganese ions : https://www.sciencedirect.com/science/article/abs/pii/S0378775315004553










[…] Vous trouverez aussi des informations très intéressantes sur la chimie des accus ici. […]